8 Ecuația lui Clausius Clapeyron. Ecuația Clapeyron–Clausius. Derivarea și analiza ecuației Clapeyron–Clausius
Ecuația Clapeyron-Clausius ecuație termodinamică referitoare la procesele de trecere a unei substanțe de la o fază la alta (evaporare, topire, sublimare, transformare polimorfă etc.). Potrivit lui K. - K. u., căldura de tranziție de fază (de exemplu, căldura de evaporare, căldura de fuziune) în timpul unui proces de echilibru este determinată de expresia Unde T - temperatura de tranziție (proces izoterm), dp/dT - valoarea derivatei presiunii în raport cu temperatura la o anumită temperatură de tranziție, ( V 2 -V 1) - modificarea volumului unei substanțe în timpul trecerii acesteia de la prima fază la a doua. Ecuația a fost obținută inițial în 1834 de B. P. E. Clapeyron din analiza ciclului Carnot pentru condensarea vaporilor în echilibru termic cu un lichid. În 1850 P. Clausius a îmbunătățit ecuația și a extins-o la alte tranziții de fază. K. - K. u. aplicabil oricăror tranziții de fază însoțite de absorbția sau eliberarea de căldură (așa-numita tranziție de fază de ordinul întâi) și este o consecință directă a condițiilor de echilibru de fază (vezi Echilibrul de fază) ,
din care derivă. K. - K. u. poate fi folosit pentru a calcula oricare dintre mărimile incluse în ecuație, dacă celelalte sunt cunoscute. În special, este utilizat pentru a calcula căldura de evaporare, a cărei determinare experimentală este plină de dificultăți semnificative. Adesea K. - K. u. scris relativ la derivate dp/dT sau dT/dp:
Pentru procese de evaporare și sublimare dp/dT exprimă modificarea presiunii vaporilor saturați R cu temperatura T,și pentru procese de topire și transformare polimorfă dT/dp determină modificarea temperaturii de tranziție cu presiunea. Cu alte cuvinte, K. - K. u. este ecuația diferențială a curbei de echilibru de fază în variabile r, T.
Pentru a rezolva K. - K. u. este necesar să se știe cum se modifică cantitățile cu temperatura și presiunea L, V 1Și V 2, care este o sarcină dificilă. De obicei, această dependență este stabilită empiric și rezolvată de K. - K. u. numeric. K. - K. u. aplicabil atât substanțelor pure, cât și soluțiilor și componentelor individuale ale soluțiilor. În acest din urmă caz, K. - K. u. raportează presiunea parțială a vaporilor saturați a unei componente date de căldura sa parțială de vaporizare. Yu. I. Polyakov. Marea Enciclopedie Sovietică. - M.: Enciclopedia Sovietică.
1969-1978
.
![]()
Vedeți ce este „ecuația Clapeyron-Clausius” în alte dicționare:
CLAPEYRON MENDELEEV ECUAȚIA, ecuația de stare (vezi ECUAȚIA DE STARE) pentru un gaz ideal (vezi GAZ IDEAL), referitor la 1 mol (vezi MOL) de gaz. În 1874 D.I Mendeleev (vezi MENDELEEV Dmitry Ivanovich) bazat pe ecuația Clapeyron ... ... Dicţionar enciclopedic
ECUAȚIA CLAPEYRON-CLAUSIS- ecuație termodinamică legată de procesele de trecere a unei substanțe de la o fază la alta (evaporare, topire, transformare polimorfă etc.). Conform ecuației Clapeyron Clausis, căldura de tranziție de fază (de exemplu, căldura de topire ... Dictionar metalurgic
Ecuația de stare a unui gaz ideal, stabilind o relație între volumul acestuia V. presiune pi abs. t roy T. Are forma: pV=nRT. unde n este numărul de moli de gaz, R = 8,31431 J/mol. K) constanta de gaz. Pentru 1 mol de gaz pv=RT, unde v este volumul molar. K.M.u.... ... Enciclopedie chimică
Ecuația de stare Acest articol face parte din seria Termodinamică. Ecuația de stare a unui gaz ideal Ecuația Van der Waals Ecuația Diterici Secțiunile termodinamicii Principiile termodinamicii Ecuația ... Wikipedia
- (ecuația Clapeyron-Mendeleev), relația dintre parametrii unui gaz ideal (presiunea p, volumul V și temperatura absolută T), care determină starea acestuia: pV=BT, unde coeficient. proporționalitatea B depinde de masa gazului M și de molul acestuia. mase. Instalat…… Enciclopedie fizică
Ecuația de stat Stat ... Wikipedia
- (ecuația Clapeyron-Mendeleev), relația dintre presiunea p, temperatura absolută T și volumul V al unui gaz ideal de masă M: pV=BT, unde B=M/m (m este masa unei molecule de gaz în masa atomică unități). Înființată de omul de știință francez B.P.E. Clapeyron...... Enciclopedie modernă- Ecuația lui Clapeyron Mendeleev, găsită de B. P. E. Clapeyron (1834) relația dintre mărimile fizice care determină starea unui gaz ideal: presiunea gazului p, volumul acestuia V și temperatura absolută T. K. u.... ... Marea Enciclopedie Sovietică
Ecuația Clapeyron Mendeleev [numită după francezi. fizică B. Clapeyron (V. Clapeyron; 1799 1864) şi rusă. chimistul D.I Mendeleev (1834 1907)], nivelul de stare a unui gaz ideal: pVm = RT, unde p este presiunea, T este temperatura termodinamică a gazului, Vm ... ... Big Enciclopedic Polytechnic Dictionary
§ 3. Tranziții de fază. Ecuația Clapeyron-Clausius
Într-un sistem format din mai multe faze ale unei substanțe pure care sunt în echilibru, sunt posibile tranzițiile substanței de la o fază la alta. Astfel de tranziții sunt numite tranziții de fază sau transformări ale stărilor de agregare.
Să considerăm tranziția de echilibru a unui mol de substanță de la o fază (1) la alta (2), care are loc la presiune și temperatură constante. energiile Gibbs ( G 1 Și G 2) molii substanței din fazele 1 și 2 sunt egali (condiția de echilibru). Prin urmare:
G 2 = G 1 (III, 14)
Să scriem ecuațiile (III, 13b) ale diferențelor totale pentru energia Gibbs a unui mol de substanță pură în două faze de echilibru 1 și 2:
dG 1 = V 1 dP–S 1 dT
dG 2 = V 2 dP–S 2 dT(III, 15)
Scăzând ecuația superioară din cea inferioară, obținem:
dG 2 – dG 1 = (V 2 – V 1) dP –(S 2 – S 1) dT
Schimbări P Și T aici nu au fost independente, ci astfel încât să se mențină echilibrul între fazele 1 și 2. Astfel, între PȘi T s-a păstrat legătura funcţională corespunzătoare echilibrului de fază. Prin urmare, dacă G 1 = G 2 (echilibru de presiune P si temperatura T), Acea G 1 + dG 1 = G 2 + dG 2 (echilibru de presiune P + dP si temperatura T + dT), adică dG l = dG 2 sau dG 2 – dG 1 = 0. Prin urmare
(V 2 – V 1)dP– (S 2 – S 1)dT= 0
Transformarea reciprocă a fazelor a fost considerată aici ca echilibrată și izotermă, prin urmare:
S 2
– S 1
=
S=  =
=
 =
=
 (III, 17)
(III, 17)
Aici  – căldură de transformare de fază, absorbită în timpul tranziției unui mol de substanță din faza 1 în faza 2; V 2 –
V 1 – diferența de volume molare a două faze.
– căldură de transformare de fază, absorbită în timpul tranziției unui mol de substanță din faza 1 în faza 2; V 2 –
V 1 – diferența de volume molare a două faze.
Din ecuațiile (III, 16) și (III, 17) obținem:
 (III, 18)
(III, 18)
Ecuația (III, 18) se numește Ecuația Clapeyron - Clausius și este o ecuație termodinamică generală aplicabilă tuturor tranzițiilor de fază ale substanțelor pure, i.e. la transformări ale stărilor de agregare.
Când o fază se transformă în alta, proprietăți precum volumul specific sau molar, energia internă și entropia unui gram sau a unui mol de substanță se schimbă brusc. Cu toate acestea, din aceasta nu rezultă că energia internă a întregului sistem bifazat nu este în acest caz o funcție continuă a stării sale. De fapt, sistemul, care la începutul procesului consta, de exemplu, dintr-o anumită cantitate de gheață la 0°C și 1 ATM, la presiune constantă și aport de căldură, se transformă într-un sistem de apă gheață-lichid în două faze, în care, pe măsură ce căldura este absorbită, masa gheții scade treptat și continuu, iar masa apei crește. Prin urmare, astfel de proprietăți ale sistemului în ansamblu, cum ar fi energia internă, entalpia, entropia etc., se schimbă, de asemenea, treptat și continuu.
§ 4. Tranziții de fază de ordinul întâi. Topire. Evaporare
Tranzițiile de fază caracterizate prin egalitatea potențialelor izobare a două faze care coexistă în echilibru și o schimbare bruscă a entropiei și volumului în timpul tranziției unei substanțe de la o fază la alta se numesc tranziții de fază de ordinul întâi. Lor includ transformări agregate - topire, evaporare, sublimare etc.
Dintre tranzițiile de fază de ordinul întâi, luăm în considerare topirea și evaporarea, care sunt de interes mai general decât alte procese.
Topire. Căldura de fuziune - trecerea fazei solide în lichid - este întotdeauna pozitivă. Volumul (molar, specific) al fazei lichide ( V și = V 2) în general, poate exista mai mult sau mai puțin volum din aceeași cantitate de fază solidă ( V T = V 1). De aici, în conformitate cu ecuația (III, 18), rezultă că cantitatea dP/ dT sau inversul acesteia dT/ dP, care caracterizează schimbarea temperaturii odată cu creșterea presiunii, poate fi pozitivă sau negativă. Aceasta înseamnă că punctul de topire poate crește sau scădea odată cu creșterea presiunii.
Deci, pentru benzen ( t pl. = 5,4°C;  =
9986 J/cârtiță;V w = 87,28 cm 3 /mol;V t = 86,27 cm 3 /mol)
obținem din ecuația (III, 18):
=
9986 J/cârtiță;V w = 87,28 cm 3 /mol;V t = 86,27 cm 3 /mol)
obținem din ecuația (III, 18):
Reciproc dT/
dP =
0,0282 K/Pa. Astfel, cu creșterea presiunii în apropierea punctului de topire, punctul de topire al benzenului crește.
K/Pa. Astfel, cu creșterea presiunii în apropierea punctului de topire, punctul de topire al benzenului crește.
Magnitudinea dT/ dP pozitiv pentru marea majoritate a substanțelor. Are valoare negativă doar pentru apă, bismut și alte câteva substanțe pentru care densitatea lichidului la punctul de topire este mai mare decât densitatea fazei solide și (V și – V T )
Evaporare. Căldura de evaporare - trecerea fazei lichide în faza gazoasă - este pozitivă, la fel ca și căldura de fuziune. În acest caz, volumul (specific, molar) al gazului este întotdeauna mai mare decât volumul corespunzător de lichid, adică în ecuația (III, 18) întotdeauna V 2 > V 1 . De aceea dP/ dT, prin urmare dT/ dP sunt, de asemenea, întotdeauna pozitive. În consecință, temperatura de evaporare crește întotdeauna odată cu creșterea presiunii.
La temperaturi departe de a fi critice, densitatea vaporilor saturați este de multe ori mai mică decât densitatea lichidului, iar valoarea inversă este volumul molar (specific) de abur de multe ori mai mare decât volumul molar (specific) de lichid. Prin urmare valoarea V 1 = Vși în ecuația (III, 18) poate fi neglijat și va lua forma:
 (III, 18a)
(III, 18a)
Dacă, departe de temperatura critică, aburul saturat poate fi considerat un gaz ideal, atunci  =
RT/
P,
iar din ecuația (III, 18) obținem 1:
=
RT/
P,
iar din ecuația (III, 18) obținem 1:
 (III, 19)
(III, 19)
 (III, 19a)
(III, 19a)
Căldura de evaporare a lichidelor variază în funcție de temperatură, scăzând ușor la temperaturi medii și foarte puternic în apropierea temperaturii critice la care  = 0. De exemplu, pentru H 2 O:
= 0. De exemplu, pentru H 2 O:
|
, cal/g |
Tabelul 1. Entalpia și entropia de evaporare a unor lichide la punctul normal de fierbere (R = 1 ATM)
|
Substanţă |
T kip., K |
|
|
|
Oxigen |
|||
|
eter etilic |
|||
|
Etanol |
§ 5. Dependenţa presiunii vaporilor saturaţi de temperatură
Presiunea vaporilor saturați a unui lichid crește brusc odată cu creșterea temperaturii. Acest lucru poate fi văzut din Fig. 2, care prezintă curbele de presiune a vaporilor ale unor lichide, începând de la punctele de topire și terminând în punctele critice.
Orez. 2. Dependenţa presiunii vaporilor saturaţi a unor lichide de temperatură.
Dependența funcțională a presiunii de vapori saturați a unui lichid de temperatură poate fi exprimată prin ecuația (III, 18), iar departe de temperatura critică prin ecuația (III, 19).
Având în vedere constanta căldurii de evaporare (sublimare) într-un interval mic de temperatură, putem integra ecuația (III, 19a)
 (III, 20)
(III, 20)
Prezentând ecuația (III, 20) sub forma unei integrale nedefinite, obținem:
 (III, 21),
(III, 21),
unde C este constanta de integrare.
În conformitate cu aceste ecuații, dependența presiunii vaporilor saturați a unui lichid (sau a unei substanțe cristaline) de temperatură poate fi exprimată printr-o linie dreaptă în coordonate  (în acest caz panta dreptei este egală cu
(în acest caz panta dreptei este egală cu  ). Această dependență apare doar într-un anumit interval de temperatură, departe de cel critic.
). Această dependență apare doar într-un anumit interval de temperatură, departe de cel critic.
Figura 3 arată dependența presiunii vaporilor saturați a unor lichide în coordonatele indicate, care se potrivește satisfăcător pe linii drepte în intervalul 0-100°C.
Cu toate acestea, ecuația (III, 21) nu acoperă dependența presiunii vaporilor saturați de temperatură pe întregul interval de temperatură - de la punctul de topire până la temperatura critică. Pe de o parte, căldura de evaporare depinde de temperatură, iar integrarea trebuie realizată ținând cont de această dependență. Pe de altă parte, aburul saturat la temperaturi ridicate nu poate fi considerat un gaz ideal. Prin urmare, ecuația care acoperă dependența P = f(T) într-un interval larg de temperatură, devine inevitabil empiric.

Fig.3. Dependenţa logaritmului presiunii vaporilor saturaţi a unor lichide de temperatura inversă.
§ 6. Starea supracritică a materiei.
Stare supercritică- a patra formă a stării de agregare în care se pot transforma multe substanţe organice şi anorganice.
Starea supercritică a materiei a fost descoperită pentru prima dată de Cagniard de la Tour în 1822. Interesul real pentru noul fenomen a apărut în 1869 după experimentele lui T. Andrews. Efectuând experimente în tuburi de sticlă cu pereți groși, omul de știință a investigat proprietățile CO 2 , care se lichefiază ușor atunci când presiunea crește. Drept urmare, a constatat că la 31 ° C și 7,2 MPa, meniscul, limita care separă lichidul și vaporii în echilibru cu acesta, dispare, în timp ce sistemul devine omogen (omogen) și întregul volum capătă aspectul unui lichid opalescent alb-laptos. Odată cu o creștere suplimentară a temperaturii, devine rapid transparent și mobil, constând din jeturi care curg constant, care amintesc de fluxurile de aer cald pe o suprafață încălzită. Creșterile ulterioare ale temperaturii și presiunii nu au dus la modificări vizibile.
El a numit punctul în care are loc o astfel de tranziție critic, iar starea substanței situată deasupra acestui punct - supercritică. În ciuda faptului că în exterior această stare seamănă cu un lichid, acum se folosește un termen special pentru a se aplica - fluid supercritic (din cuvântul englezesc fluid, adică „capabil de curgere”). În literatura modernă, denumirea prescurtată pentru fluidele supercritice este SCF.
Locația liniilor care delimitează regiunile de stare gazoasă, lichidă și solidă, precum și poziția punctului triplu în care converg toate cele trei regiuni, sunt individuale pentru fiecare substanță. Regiunea supercritică începe în punctul critic (indicat printr-un asterisc), care este cu siguranță caracterizat de doi parametri - temperatura ( T cr.) și presiune ( R cr.). O scădere a temperaturii sau a presiunii sub valorile critice scoate substanța din starea supercritică.

Faptul existenței unui punct critic a făcut posibil să se înțeleagă de ce unele gaze, de exemplu, hidrogenul, azotul și oxigenul, pentru o lungă perioadă de timp nu au putut fi obținute sub formă lichidă cu creșterea presiunii, motiv pentru care au fost numite gaze permanente. (din latină permanents- "constant"). Diagrama de mai sus arată că regiunea de existență a fazei lichide este situată în stânga liniei de temperatură critică. Astfel, pentru a lichefia orice gaz, acesta trebuie mai întâi răcit la sub o temperatură critică. U CO 2 temperatura critică este peste temperatura camerei, deci poate fi lichefiată în condiții specificate prin creșterea presiunii. Azotul are o temperatură critică mult mai scăzută: -146,95 ° C, prin urmare, dacă comprimați azotul în condiții normale, puteți ajunge în cele din urmă în regiunea supercritică, dar azotul lichid nu se poate forma. Este necesar să se răcească mai întâi azotul sub o temperatură critică și apoi, prin creșterea presiunii, să se ajungă în regiunea în care existența lichidului este posibilă. Situația este similară pentru hidrogen și oxigen, așa că înainte de lichefiere, acestea sunt răcite la o temperatură sub critică și abia atunci presiunea este crescută. Starea supercritică este posibilă pentru majoritatea substanțelor este necesar doar ca substanța să nu se descompună la o temperatură critică. În comparație cu aceste substanțe, punctul critic al apei este atins cu mare dificultate: t cr = 374,2°C și R cr = 21,4 MPa.
Punctul critic este recunoscut ca un parametru fizic important al unei substanțe, la fel ca punctele de topire sau de fierbere. Densitatea SCF este extrem de scăzută, de exemplu, apa în starea SCF are o densitate de trei ori mai mică decât în condiții normale. Toate SCF au vâscozitate extrem de scăzută.
Fluidele supercritice sunt o încrucișare între un lichid și un gaz. Ele pot fi comprimate ca gazele (lichidele obișnuite sunt practic incompresibile) și, în același timp, sunt capabile să dizolve multe substanțe în stare solidă și lichidă, ceea ce este neobișnuit pentru gaze. Etanolul supercritic (la temperaturi peste 234 ° C) dizolvă foarte ușor unele săruri anorganice ( CoCl 2 , KBr, KI). Dioxidul de carbon, protoxidul de azot, etilena și alte gaze în starea SCF dobândesc capacitatea de a dizolva multe substanțe organice - acid stearic, parafină, naftalină. Proprietățile supercritice CO 2 Ca solvent, poate fi reglat - odată cu creșterea presiunii, capacitatea sa de dizolvare crește brusc.
Fluidele supercritice au devenit utilizate pe scară largă abia în anii 1980, când nivelul general de dezvoltare industrială a făcut ca instalațiile SCF să fie disponibile pe scară largă. Din acel moment a început dezvoltarea intensivă a tehnologiilor supercritice. SCF nu sunt doar solvenți buni, ci și substanțe cu un coeficient de difuzie ridicat, adică. ele pătrund cu ușurință în straturile adânci ale diverselor solide și materiale. Cel mai utilizat este supercritic CO 2 , care s-a dovedit a fi un solvent pentru o gamă largă de compuși organici. Dioxidul de carbon a devenit lider în lumea tehnologiilor supercritice deoarece... are o serie întreagă de avantaje. Este destul de ușor să-l transferați într-o stare supercritică ( t cr – 31°C, R cr – 73,8 ATM.), în plus, este netoxic, neinflamabil, neexploziv, în plus, este ieftin și disponibil. Din punctul de vedere al oricărui tehnolog, este o componentă ideală a oricărui proces. Ceea ce îl face deosebit de atractiv este faptul că este o parte integrantă a aerului atmosferic și, prin urmare, nu poluează mediul. Supercritic CO 2 poate fi considerat un solvent ecologic, absolut curat. Să dăm doar câteva exemple de utilizare a acestuia.
Cofeina, un medicament folosit pentru a îmbunătăți funcționarea sistemului cardiovascular, se obține din boabele de cafea chiar și fără a le măcina mai întâi. Extracția completă se realizează datorită capacității mari de penetrare a SCF. Boabele sunt plasate într-o autoclavă - un recipient care poate rezista la presiune mare, apoi gazos CO 2 , apoi creați presiunea necesară (>73 ATM.), ca urmare CO 2 intră într-o stare supercritică. Tot conținutul este amestecat, după care lichidul împreună cu cofeina dizolvată este turnat într-un recipient deschis. Dioxidul de carbon, odată expus la presiunea atmosferică, se transformă într-un gaz și scapă în atmosferă, în timp ce cofeina extrasă rămâne în forma sa pură într-un recipient deschis.
Utilizarea SCF s-a dovedit a avea un mare succes în curățarea contaminanților din circuitele electronice în timpul procesului lor de fabricație, deoarece nu rămân urme de solvent de curățare pe acestea.
Datorită ritmului rapid de producție a părții active a rezervelor de petrol ușor, interesul pentru metodele de creștere a recuperării petrolului a crescut brusc. Dacă în anii 70-80 ai secolului al XX-lea numărul de proiecte care vizau rezolvarea problemei creșterii recuperării petrolului prin injectarea de solvenți cu hidrocarburi miscibili, gaze „inerte” și dioxid de carbon era comparabil, atunci la sfârșitul secolului XX și începutul secolului XX. Secolul 21 doar metoda de injectare CO 2 a avut o tendință de creștere constantă. Eficiența aplicării CO 2 pentru creșterea recuperării petrolului a fost dovedit nu numai prin lucrări experimentale și teoretice, ci și prin rezultatele a numeroase teste industriale.
Nu uitați că tehnologia de recuperare îmbunătățită a uleiului folosind CO 2 ne permite să rezolvăm simultan problema conservării cantității uriașe de dioxid de carbon eliberat de industrie.
Caracteristicile procesului de expunere la injectat CO 2 asupra unui zăcământ de petrol și gaze depind de starea sa de agregare.
Excesul de presiune și temperatură peste valorile critice pentru dioxid de carbon (și aceasta este cea mai probabilă situație în condiții de rezervor) predetermina starea sa supercritică. În acest caz CO 2 , care are o capacitate de dizolvare excepțională în raport cu lichidele de hidrocarburi atunci când este dizolvat direct în uleiul de rezervor, își reduce vâscozitatea și îmbunătățește dramatic proprietățile de filtrare. Această circumstanță oferă toate motivele pentru a clasifica SCF – tehnologii îmbunătățite de recuperare a petrolului – drept una dintre cele mai promițătoare.
Fizic chimie(organic chimie, partea I). V.A Startseva, L.E Nikitina, N.P. ...
Testul nr. 2 la chimie fizică
DocumentTestul nr. 2 pe fizic chimie Opțiunea 2 Care este temperatura... . Testul nr. 2 pe fizic chimie Opțiunea 3 Enumerați mărimile fizice și chimice... Testul nr. 2 pe fizic chimie Opțiunea 12 Electrozi de determinare. ...
Manual metodologic pentru lucrări de laborator nr.4 la cursul de chimie fizică pentru studenții cu normă întreagă ai Facultății de Tehnologie Chimică și ai Facultății de Știința Materialelor de Construcții
Trusa de instrumenteVALORI ALE CONSTANTEI DE ECHILIBRI ÎN Practici privind fizic chimie Există adesea lucrări de laborator referitoare la... p. 3. Petrov N.A., Cherepanov V.A. Ermishina Yu.A. Atelier pe fizic chimie. Trusa de instrumente. Ekaterinburg: publicarea...
Program examen de admitere la specialitatea 02.00.04 „chimie fizică”
ProgramEchilibrul // M.: Metalurgie.-1988.-560 p. Bine fizic chimie/ EU SI. Gerasimov, V.P. Dreving, E.I. Ermin et al.: sub... .- 1980.- 180 p. Gorshkov B.I., Kuznetsov I.A. / Bazele fizic chimie. a 2-a ed. // M.: Editura Universității din Moscova...
Într-un sistem format din mai multe faze ale unei substanțe pure, sunt posibile tranzițiile substanței de la o fază la alta. Astfel de tranziții sunt numite tranziții de fază. Tranzițiile de fază sunt caracterizate prin dependența temperaturii de transformare de fază de presiunea externă sau presiunea vaporilor saturați de temperatura sistemului. O ecuație care caracterizează astfel de dependențe a fost propusă de Clapeyron și ulterior modificată de Clausius.
Fie ca 1 mol dintr-o substanță să treacă în echilibru de la o fază (1) la alta (2) la r, T= const. Să ne limităm să luăm în considerare tranziții de fază de ordinul întâi, care se caracterizează prin egalitatea potențialelor izobare ale celor două faze și o schimbare bruscă a entropiei Sși volum V.
Tranzițiile de fază de ordinul întâi includ următoarele tranziții izoterme:
(evaporare),
(sublimare),
(topire, cristalizare).
Condiția de echilibru este egalitatea energiilor molare Gibbs ale substanței în două faze: G 1 = G 2. Dacă RȘi T schimba simultan la dpȘi dT, Acea G se va schimba, de asemenea, în dG iar noua condiţie de echilibru va fi scrisă ca
Din relație (2,40) ![]() urmează că
urmează că
Acesta este... (14)
Având în vedere că
unde D V = V 2 - V 1 - diferența de volume molare a două faze, D S si D H- modificarea entropiei și entalpiei unei substanțe în timpul tranziției a 1 mol de substanță dintr-o fază (1) în alta (2). Ecuația (4.16) se numește Ecuația Clapeyron-Clausius. Stabilește o legătură între o modificare a temperaturii unei tranziții de fază cu o schimbare a presiunii externe sau o modificare a presiunii vaporilor saturați cu o schimbare a temperaturii, pe de o parte, și căldura unei tranziții de fază și o schimbare a volumul unei substanțe în timpul unei tranziții de fază, pe de altă parte.
1) Luați în considerare aplicarea ecuației (4.16) la procesele de topire . În acest caz, ecuația Clapeyron-Clausius este de obicei folosită sub următoarea formă:
Din moment ce D pl N> 0, semnul derivatei depinde de semnul lui D V. Pentru majoritatea substanțelor
![]() > 0 > 0,
> 0 > 0,
La dreapta.
Pentru câteva substanțe, inclusiv apă, bismut, galiu, fontă:
![]() < 0 < 0,
< 0 < 0,
care corespunde pantei curbei pentru această tranziție de fază stânga.
Deci, dacă atunci când o substanță se topește, volumul ei molar scade, atunci
adică Pe măsură ce presiunea externă crește, punctul de topire al substanței scade.
Dacă topirea este însoțită de o creștere a volumului molar, atunci
adică Pe măsură ce presiunea externă crește, crește și punctul de topire al substanței.
2). Luați în considerare aplicarea ecuației (4.16) la procesele de evaporare şi sublimare .
Pentru procesele de evaporare sau sublimare, ecuația Clapeyron-Clausius se scrie ca
 , (18)
, (18)
Unde V K este volumul fazei condensate (lichid V F sau solid V TELEVIZOR). La temperaturi mult mai scăzute decât cele critice (la T KR: V F = V P), putem neglija volumul fazei lichide în comparație cu volumul aceleiași cantități de vapori. Ca rezultat, ecuația (18) este transformată în
La presiuni și temperaturi scăzute, legile gazelor ideale () pot fi aplicate aburului și volumul aburului poate fi exclus din ecuația (19). Apoi
![]() . (20)
. (20)
În sfârșit, pentru procesul de evaporare sau sublimare obținem ( diferențială) forma ecuației Clapeyron-Clausius:
![]() . (21)
. (21)
Dacă acceptăm D perechi N valoare constantă (ceea ce este posibil pentru intervale mici de temperatură), apoi după integrarea ecuației (21) obținem forma integrală a ecuației Clapeyron-Clausius:
![]() , (22)
, (22)
 . (23)
. (23)
Aceste ecuații stabilesc o legătură explicită între căldura de vaporizare a unei substanțe și dependența presiunii vaporilor saturați de temperatură.
Deci, pentru procesele de vaporizare ![]() ,
,
adică Pe măsură ce temperatura crește, presiunea vaporilor saturați a substanței crește.
Spre deosebire de punctul de topire, punctul de fierbere este foarte dependent de presiune, care este asociată cu valoarea mare a lui D. V, care este însoțită de procesele de evaporare și sublimare.
Spre deosebire de căldura de vaporizare, care variază mult, entropia de vaporizare- valoarea este mai mult sau mai puțin constantă. Pentru multe substanțe anorganice și organice este adevărat regula lui Truton:
![]() 89 J/(mol K), (24),
89 J/(mol K), (24),
Unde T b.t.b. - punctul normal de fierbere al unui lichid, de ex. punctul de fierbere la presiunea externă egal cu 1 atm.
În timpul tranzițiilor unei substanțe individuale de la o stare de agregare la alta, fiecare presiune corespunde unei anumite temperaturi la care fazele se află într-o stare de echilibru termodinamic. Dependența presiunii de tranziție de fază de temperatură este descrisă de ecuația Clapeyron-Clausius, derivată pe baza celei de-a doua legi a termodinamicii. Pentru a deriva această ecuație, luați în considerare în p- v μ-coordonate este un ciclu elementar corespunzător ariei 1-2-3-4 (Fig. 30).
Să presupunem că în punctul f există 1 kmol dintr-un fluid de lucru, de exemplu lichid. În procesul corespunzător liniei 1-2, căldura este furnizată la presiune constantă și la constantă
temperatură, lichidul se transformă în vapori. Prin urmare, procesul corespunzător liniei 1-2 este izobar-izotermic. Când un lichid se transformă în vapori, acesta crește în volum din V" μ, la punctul 1 la V"" μ, la punctul 2. La punctul 2, tot lichidul se va transforma în vapori. Vaporizarea are loc din cauza căldurii furnizate Î 1, egală cu căldura de vaporizare (r).
Lăsați vaporii din punctul 2 să se extindă adiabatic până la un volum corespunzător volumului din punctul 3, cu o ușoară modificare a presiunii de la R inainte de (p-dp).. Temperatura va scădea de la T inainte de (T-dT). Apoi la temperaturi constante (T -dT) si presiune (p - dp) Să comprimăm aburul la un volum corespunzător punctului 4. La punctul 4, tot aburul se va condensa și se va transforma în lichid.
Căldura îndepărtată în procesul corespunzător liniei 3-4 este egală cu Q2 = Q1 - 5Q.
Să înlocuim procesul 4-1 cu procesul adiabatic 4"-1 al trecerii lichidului la starea corespunzătoare punctului 1. Datorită valorii mici a dp, o modificare a diferenței de volum (V" μ - V" μ)Și (V 3 μ - V 4 μ,) poate fi neglijat. Apoi ciclul 1-2-3-4 se transformă într-un ciclu Carnot elementar 1-2-3-4”, pentru care sunt valabile egalitățile.
δL = (V" μ - V" μ) dp
η t = [T - (T - dT)]/T = dT/T.
Deoarece randamentul termic al ciclului Carnot poate fi scris si sub forma η t = δL/Q l apoi, înlocuind în această egalitate Î 1 pe r iar echivalând laturile drepte ale relațiilor obținute pentru η t, putem scrie
δL/r = dT/T
Înlocuind valoarea rezultată în loc de δL, obținem
[(V" μ - V" μ) dp]/r = dt/T
dp/dT = r/. (173)
Ecuația (173) se numește ecuația Clapeyron-Clausius. Folosind această ecuație, se determină presiunea sau temperatura în timpul tranziției unei substanțe individuale de la starea lichidă la starea gazoasă, precum și volumul (în raport cu aburul) și căldura de vaporizare. Pentru orice altă tranziție de fază a unei substanțe de la o stare la alta din ecuația (173), r ar trebui înlocuit cu λ - căldura de tranziție de fază (din diferite faze) în condiții de echilibru. Apoi
dp/dT = λ/ (174)
Ecuația Clapeyron-Clausius (174) poate fi derivată într-un alt mod, bazat pe egalitatea potențialelor chimice la echilibru.
După cum sa arătat mai devreme, condiția pentru echilibrul unui sistem cu două faze (la aceeași presiune și temperatură a ambelor faze) este egalitatea potențialelor lor chimice (vezi Fig. 25), adică. μ" = μ" , Unde μ" Și μ" - potențialele chimice ale unei substanțe individuale în prima și respectiv a doua fază.
Deoarece pentru un sistem cu o singură componentă potențialul chimic este egal cu energia Gibbs kilomolară μ = G/n, atunci condiția de echilibru poate fi scrisă ca dG"/dn" = dG"/dn".
Având în vedere că o scădere a cantității unei substanțe într-o fază trebuie să fie egală cu creșterea acesteia într-o altă fază, starea de echilibru poate fi scrisă și ca egalitatea energiilor Gibbs în prima și a doua fază, adică. dG" = dG". După ce s-a exprimat dG"Și dG" prin parametrii corespunzători (110), obţinem
V" μ dp - S"dT = V"" μ dp - S"dT.
dp/dT = (S"" - S")/ (V" μ - V" μ)
Având în vedere că incrementul de entropie este egal cu ΔS = ΔQ/T, iar înlocuind în ecuația rezultată căldura furnizată în timpul procesului de trecere a unei substanțe de la o fază la alta prin λ, obținem ecuația Clapeyron-Clausius (174):
dp/dT = λ/.
Când se consideră procesul de vaporizare după volumul de lichid V" μ poate fi neglijat datorita micimii sale fata de volumul de abur V" μ. Atunci ecuația (174) poate fi scrisă ca
dp/dT=λp/T V" μ (175)
Dacă înlocuim volumul de abur din ecuația Mendeleev-Clapeyron (2) cu RT/p, atunci ecuația Clapeyron-Clausius va avea forma
dp/dT = λp/RT 2
sau, mutând p în partea stângă a egalității și înlocuind dp/p pe d (ln p), primim
d (In p)/dT = X/RT2.(176)
![]() (177)
(177)
unde C = const.
Dacă mai facem o ipoteză, adică să presupunem că λ nu depinde de temperatură (λ = const) și integrăm ecuația (177), atunci pentru un interval mic de temperatură dependența aproximativă a presiunii de temperatură are forma
log р = - λ/2.303RT + С
![]() (178)
(178)
unde C = const.
Astfel, folosind formula (178), cu suficientă precizie pentru practică, este posibil să se determine căldura de vaporizare (sau altă tranziție de fază) de la cunoscutele p 1 și p 2, temperaturile lor corespunzătoare T 1 și T 2 cu o mică diferență. între ele.
Ecuația Clapeyron-Clausius (173) caracterizează tranzițiile de fază însoțite de absorbția sau eliberarea de căldură. Astfel de tranziții sunt cauzate de egalitatea energiei Gibbs a două faze aflate în echilibru și de schimbarea bruscă a primelor sale derivate, adică volumul V = ( dG/dp) T și entropia S = - ( dG/dp) R.
Aceste tranziții sunt numite tranziții de fază de ordinul întâi (acestea includ evaporarea și condensarea, topirea și cristalizarea) și, prin urmare, ecuația Clapeyron-Clausius reflectă caracteristicile unei tranziții de ordinul întâi.
Pe lângă tranzițiile de fază de ordinul întâi, există și tranziții de fază de ordinul doi. Ehrenfest a fost primul care a exprimat idei despre tranzițiile de al doilea fel, explicând fenomenele de tranziție a heliului de la o stare la alta.
Tranzițiile de ordinul doi se caracterizează prin absența eliberării și absorbției de căldură și, în consecință, egalitatea volumului și entropiei fazelor care coexistă în echilibru. Aceste tranziții sunt, de asemenea, caracterizate printr-o schimbare bruscă a derivatelor secunde ale energiei Gibbs, care sunt mărimi fizice precum capacitatea de căldură.
μc p = - T(d 2 G/dT 2) p
coeficientul de dilatare termică

și factorul de compresibilitate

Toate substanțele pot exista în diferite stări de agregare sau în diferite modificări ale unei stări de agregare, în funcție de condiții ( T, r etc.). Tranziția unei substanțe de la o stare de agregare la alta sau o schimbare în modificarea stării de agregare a unei substanțe se numește tranziție de fază de ordinul întâi. Tranzițiile de fază de ordinul I sunt însoțite de eliberarea sau absorbția de căldură.
|
![]() . (25)
. (25)
În echilibru dinamic, este valabilă următoarea ecuație:
![]() , (26)
, (26)
Unde g 1Și g 2– potențiale termodinamice specifice (pe unitate de masă a substanței) fazei I și II.
O ecuație care raportează presiunea și temperatura la care tranziție de fază de ordinul întâi, are forma
unde este volumul specific. Oricare două faze ale unei substanțe pot fi în echilibru numai la o anumită presiune, în funcție de temperatură.
Numărul maxim posibil de faze ale unei substanțe care sunt în echilibru între ele este de trei, dacă aceasta este reprezentată pe un plan p, T, apoi va fi împărțit în trei regiuni: fază solidă (e), lichidă (g) și gazoasă (g), Fig. 20
Limitele fazelor de contact sunt curbe de sublimare(evaporare solidă), evaporareȘi topire, care caracterizează stările de echilibru în două faze.
Diagrame similare sunt construite experimental pentru diferite substanțe, ele fac posibilă prezicerea stărilor de echilibru în care se poate afla o substanță la anumite valori de presiune și temperatură, precum și când și ce transformări de fază va experimenta în timpul unui anumit proces. De exemplu, curba de evaporare se termină în punctul critic LA Prin urmare, o tranziție continuă a unei substanțe de la o stare lichidă la o stare gazoasă și înapoi este posibilă ocolind punctul LA„de sus”, în acest caz, o astfel de tranziție nu este însoțită de o stare în două faze.
Sarcini
6.1. Obține ecuația Clapeyron-Clausius folosind metoda ciclului.
6.2. Deduceți ecuația Clapeyron-Clausius folosind metoda potențialului termodinamic.
6.3.
Sulful ortorombic se transformă în monoclinic la . La presiunea atmosferică, căldura specifică de transformare ![]() . Salt în volumul specific de sulf în timpul transformării de fază. Aflați deplasarea punctului de tranziție de fază al sulfului când presiunea se modifică cu .
. Salt în volumul specific de sulf în timpul transformării de fază. Aflați deplasarea punctului de tranziție de fază al sulfului când presiunea se modifică cu .
6.4. O bucată de masă de gheață este încălzită continuu la presiunea atmosferică de la o temperatură până la până când întreaga substanță se transformă în abur. Construiți un grafic al dependenței entropiei apei de temperatura absolută pe întregul interval de temperatură de mai sus.
6.5. Când temperatura tranziției fazei lichid-vapor se apropie de temperatura critică T k căldura specifică de evaporare (condensare) tinde spre zero. Explicați această proprietate folosind ecuația Clapeyron-Clausius.
6.6.
Un vas închis cu un volum conține 1 kg de apă la o temperatură. Spațiul de deasupra apei este ocupat de vapori de apă saturați (aerul a fost pompat). Aflați creșterea masei vaporilor saturați atunci când temperatura sistemului crește cu . Căldura specifică de vaporizare ![]() . Când calculați, considerați perechile ca fiind gaze ideale. Neglijați volumul specific de apă în comparație cu volumul specific de abur.
. Când calculați, considerați perechile ca fiind gaze ideale. Neglijați volumul specific de apă în comparație cu volumul specific de abur.
6.7 Găsiți dependența presiunii vaporilor saturați de temperatură în baza următoarelor ipoteze simplificatoare: căldură specifică de vaporizare q luați în considerare independent de temperatură; volumul specific de lichid este neglijabil
mic în comparație cu volumul specific de abur; Ecuația de stare Clapeyron este aplicabilă lichidelor. (Aceste simplificări sunt acceptabile departe de temperatura critică, dacă intervalul de temperatură nu este prea larg.)
6.8.
O bucată de gheață este plasată într-o înveliș adiabatic la o temperatură de 0˚C și presiunea atmosferică. Cum se va schimba temperatura gheții dacă este comprimată adiabatic la o presiune? Ce fracție de gheață se va topi? Volume specifice de apă ![]() , gheata
, gheata ![]() . Capacitatile termice ale apei si ghetii sunt legate prin relatie.
. Capacitatile termice ale apei si ghetii sunt legate prin relatie.
Răspunsuri
6.3. ![]()
 ,
, ,
,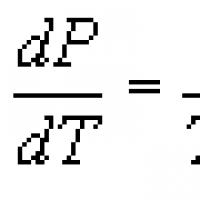 Ecuația Clapeyron–Clausius
Ecuația Clapeyron–Clausius Salariile plătite în plus: acțiunile angajatului și ale angajatorului
Salariile plătite în plus: acțiunile angajatului și ale angajatorului Caca verde la un copil: pericol normal sau grav Caca verde pentru un copil de 6 luni
Caca verde la un copil: pericol normal sau grav Caca verde pentru un copil de 6 luni Cum ar trebui să procedeze un cetățean al Federației Ruse pentru a obține în mod independent o înregistrare temporară la locul de reședință?
Cum ar trebui să procedeze un cetățean al Federației Ruse pentru a obține în mod independent o înregistrare temporară la locul de reședință? Expoziție de carte „Edges of Ages”
Expoziție de carte „Edges of Ages” Biografia Elenei din bătălia psihicilor
Biografia Elenei din bătălia psihicilor Războiul polono-lituanian – o întrebare despre viitor sau trecut?
Războiul polono-lituanian – o întrebare despre viitor sau trecut?