Як зробити електронну формулу з хімії. Хімічні формули речовин. Приклади складання електронних формул
Шпаргалка з формулами з фізики для ЄДІ
і не тільки (може знадобитися 7, 8, 9, 10 та 11 класам).
Спочатку картинка, яку можна роздрукувати в компактному вигляді.
Механіка
- Тиск Р=F/S
- Щільність ρ=m/V
- Тиск на глибині рідини P=ρ∙g∙h
- Сила тяжіння Fт = mg
- 5. Архімедова сила Fa=ρ ж ∙g∙Vт
- Рівняння руху при рівноприскореному русі
X = X 0 + υ 0 ∙t+(a∙t 2)/2 S=( υ 2 -υ 0 2) /2а S = ( υ +υ 0) ∙t /2
- Рівняння швидкості при рівноприскореному русі υ =υ 0 +a∙t
- Прискорення a = ( υ -υ 0)/t
- Швидкість під час руху по колу υ =2πR/Т
- Центрошвидке прискорення a= υ 2 /R
- Зв'язок періоду із частотою ν=1/T=ω/2π
- II закон Ньютона F=ma
- Закон Гука Fy=-kx
- Закон Всесвітнього тяжіння F=G∙M∙m/R 2
- Вага тіла, що рухається із прискоренням а Р=m(g+a)
- Вага тіла, що рухається з прискоренням а Р = m (g-a)
- Сила тертя Fтр=µN
- Імпульс тіла p=m υ
- Імпульс сили Ft=∆p
- Момент сили M=F∙ℓ
- Потенційна енергія тіла, піднятого над землею Eп=mgh
- Потенційна енергія пружно деформованого тіла Eп = kx 2 /2
- Кінетична енергія тіла Ek=m υ 2 /2
- Робота A=F∙S∙cosα
- Потужність N=A/t=F∙ υ
- Коефіцієнт корисної дії η=Aп/Аз
- Період коливань математичного маятника T=2π√ℓ/g
- Період коливань пружинного маятника T=2 π √m/k
- Рівняння гармонійних коливань Х=Хmax∙cos ωt
- Зв'язок довжини хвилі, її швидкості та періоду λ= υ Т
Молекулярна фізика та термодинаміка
- Кількість речовини ν=N/ Na
- Молярна маса М=m/ν
- Cр. кін. енергія молекул одноатомного газу Ek=3/2∙kT
- Основне рівняння МКТ P=nkT=1/3nm 0 υ 2
- Закон Гей – Люссака (ізобарний процес) V/T = const
- Закон Шарля (ізохорний процес) P/T = const
- Відносна вологість φ=P/P 0 ∙100%
- внутр. Енергія ідеал. одноатомного газу U=3/2∙M/µ∙RT
- Робота газу A=P∙ΔV
- Закон Бойля - Маріотта (ізотермічний процес) PV = const
- Кількість теплоти при нагріванні Q=Cm(T 2 -T 1)
- Кількість теплоти при плавленні Q=λm
- Кількість теплоти при пароутворенні Q = Lm
- Кількість теплоти при згорянні палива Q=qm
- Рівнення стану ідеального газу PV=m/M∙RT
- Перший закон термодинаміки ΔU=A+Q
- ККД теплових двигунів η = (Q 1 - Q 2) / Q 1
- ККД ідеал. двигунів (цикл Карно) η= (Т 1 - Т 2)/ Т 1
Електростатика та електродинаміка – формули з фізики
- Закон Кулона F=k∙q 1 ∙q 2 /R 2
- Напруженість електричного поля E=F/q
- Напруженість ел. поля точкового заряду E=k∙q/R 2
- Поверхнева густина зарядів σ = q/S
- Напруженість ел. поля нескінченної площини E=2πkσ
- Діелектрична проникність ε=E 0 /E
- Потенційна енергія взаємодій. зарядів W= k∙q 1 q 2 /R
- Потенціал φ=W/q
- Потенціал точкового заряду φ=k∙q/R
- Напруга U=A/q
- Для однорідного електричного поля U=E∙d
- Електроємність C=q/U
- Електроємність плоского конденсатора C=S∙ ε ∙ε 0 /d
- Енергія зарядженого конденсатора W=qU/2=q²/2С=CU²/2
- Сила струму I=q/t
- Опір провідника R=ρ∙ℓ/S
- Закон Ома для ділянки ланцюга I=U/R
- Закони послід. з'єднання I 1 =I 2 =I, U 1 +U 2 =U, R 1 +R 2 =R
- Закони паралл. з'єдн. U 1 =U 2 =U, I 1 +I 2 =I, 1/R 1 +1/R 2 =1/R
- Потужність електричного струму P=I∙U
- Закон Джоуля-Ленца Q=I 2 Rt
- Закон Ома для повного ланцюга I=ε/(R+r)
- Струм короткого замикання (R=0) I=ε/r
- Вектор магнітної індукції B=Fmax/ℓ∙I
- Сила Ампера Fa=IBℓsin α
- Сила Лоренца Fл = Bqυsin α
- Магнітний потік Ф=BSсos α Ф=LI
- Закон електромагнітної індукції Ei=ΔФ/Δt
- ЕРС індукції в рух провіднику Ei = Вℓ υ sinα
- ЕРС самоіндукції Esi=-L∙ΔI/Δt
- Енергія магнітного поля котушки Wм = LI 2 /2
- Період коливань кільк. контуру T=2π ∙√LC
- Індуктивний опір X L =ωL=2πLν
- Ємнісний опір Xc=1/ωC
- Чинне значення сили струму Iд=Imax/√2,
- Чинне значення напруги Uд=Umax/√2
- Повний опір Z = √ (Xc-X L) 2 +R 2
Оптика
- Закон заломлення світла n 21 = n 2 / n 1 = υ 1 / υ 2
- Показник заломлення n 21 = sin α/sin γ
- Формула тонкої лінзи 1/F=1/d + 1/f
- Оптична сила лінзи D=1/F
- max інтерференції: Δd=kλ,
- min інтерференції: Δd=(2k+1)λ/2
- Диф.решітка d∙sin φ=k λ
Квантова фізика
- Ф-ла Ейнштейна для фотоефекту hν=Aвих+Ek, Ek=U з е
- Червона межа фотоефекту ν до = Aвих/h
- Імпульс фотона P=mc=h/λ=Е/с
Фізика атомного ядра
- Закон радіоактивного розпаду N=N 0 ∙2 - t/T
- Енергія зв'язку атомних ядер
Хімічні формули – це зображення за допомогою символів.
Знаки хімічних елементів
Хімічний знакабо хімічний символ елемент– це перша чи дві перші букви від латинської назви цього елемента.
Наприклад: Ferrum –Fe , Cuprum –Cu , Oxygenium –Oі т.д.
Таблиця 1: Інформація, що дає хімічний знак
| Відомості | На прикладі Cl |
| Назва елемента | Хлор |
| Неметал, галоген | |
| Один елемент | 1 атом хлору |
| (Ar)даного елемента | Ar(Cl) = 35,5 |
| Абсолютна атомна маса хімічного елемента
m = Ar · 1,66 · 10 -24 г = Ar · 1,66 · 10 -27 кг |
M (Cl) = 35,5 · 1,66 · 10 -24 = 58,9 · 10 -24 г |
Назва хімічного знака здебільшого читається як назва хімічного елемента. Наприклад, К – калій, Са – кальцій, Mg – магній, Mn – марганець.
Випадки, коли назва хімічного знака читається інакше, наведено у таблиці 2:
| Назва хімічного елемента | Хімічний знак | Назва хімічного знаку
(вимова) |
| Азот | N | Ен |
| Водень | H | Аш |
| Залізо | Fe | Феррум |
| Золото | Au | Аурум |
| Кисень | O | Про |
| Кремній | Si | Сіліціум |
| Мідь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гідраргіум |
| Свинець | Pb | Плюмбум |
| Сірка | S | Ес |
| Срібло | Ag | Аргентум |
| Вуглець | C | Це |
| Фосфор | P | Пе |
Хімічні формули простих речовин
Хімічними формулами більшості простих речовин (всіх металів та багатьох неметалів) є знаки відповідних хімічних елементів.
Так речовина залізоі хімічний елемент залізопозначаються однаково - Fe .
Якщо має молекулярну структуру (є у вигляді , то його формулою є хімічний знак елемента з індексомвнизу праворуч, що вказує число атоміву молекулі: H 2, O 2, O 3, N 2, F 2, Cl 2, Br 2, P 4, S 8.
Таблиця 3: Інформація, що дає хімічний знак
| Відомості | На прикладі C |
| Назва речовини | Вуглець (алмаз, графіт, графен, карбін) |
| Приналежність елемента до цього класу хімічних елементів | Неметал |
| Один атом елемента | 1 атом вуглецю |
| Відносна атомна маса (Ar)елемента, що утворює речовину | Ar(C) = 12 |
| Абсолютна атомна маса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10 -24 г |
| Одна речовина | 1 моль вуглецю, тобто. 6,02 · 10 23атомів вуглецю |
| M (C) = Ar (C) = 12 г/моль |
Хімічні формули складних речовин
Формулу складної речовини складають шляхом запису знаків хімічних елементів, з яких ця речовина складається, із зазначенням числа атомів кожного елемента в молекулі. При цьому зазвичай хімічні елементи записують у порядку збільшення їх електронегативності відповідно до наступного практичного ряду:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Наприклад, H 2 O , CaSO 4 , Al 2 O 3 , CS 2 , OF 2 , NaH.
Виняток становлять:
- деякі сполуки азоту з воднем (наприклад, аміак NH 3 , гідразин N 2H 4 );
- солі органічних кислот (наприклад, форміат натрію HCOONa , ацетат кальцію (CH 3COO) 2Ca) ;
- вуглеводні ( CH 4 , C 2 H 4 , C 2 H 2 ).
Хімічні формули речовин, що існують у вигляді димерів (NO 2 , P 2O 3 , P2O5, солі одновалентної ртуті, наприклад: HgCl , HgNO 3та ін), записують у вигляді N 2 O 4 ,P 4 O 6 ,P 4 O 10 ,Hg 2 Cl 2 ,Hg 2 ( NO 3) 2 .
Число атомів хімічного елемента в молекулі та складному іоні визначається на підставі поняття валентностіабо ступеня окисленнята записується індексом внизу праворучвід символу кожного елемента (індекс 1 опускається). При цьому виходять із правила:
алгебраїчна сума ступенів окиснення всіх атомів у молекулі повинна дорівнювати нулю (молекули електронейтральні), а у складному іоні – заряду іона.
Наприклад:
2Al 3 + +3SO 4 2- =Al 2 (SO 4) 3
Цим же правилом користуються при визначенні ступеня окиснення хімічного елемента за формулою речовини чи складного. Зазвичай це елемент, що має кілька ступенів окиснення. Ступені окиснення інших елементів, що утворюють молекулу або іон повинні бути відомі.
Заряд складного іона - це алгебраїчна сума ступенів окиснення всіх атомів, що утворюють іон. Тому щодо ступеня окислення хімічного елемента у складному іоні сам іон залежить від дужки, яке заряд виноситься за дужки.
При складанні формул за валентністюречовину представляють як сполуку, що складається з двох частинок різного типу, валентності яких відомі. Далі користуються правилом:
у молекулі добуток валентності на число частинок одного типу має дорівнювати добутку валентності на число частинок іншого типу.
Наприклад:
Цифра, що стоїть перед формулою у рівнянні реакції, називається коефіцієнтом. Вона вказує або число молекул, або кількість молей речовини.
Коефіцієнт, що стоїть перед хімічним знаком, вказує число атомів даного хімічного елемента, а у випадку, коли знак є формулою простої речовини, коефіцієнт вказує або число атомів, або кількість молей цієї речовини.
Наприклад:
- 3 Fe– три атоми заліза, 3 моль атомів заліза,
- 2 H– два атоми водню, 2 моль атомів водню,
- H 2- Одна молекула водню, 1 моль водню.
Хімічні формули багатьох речовин були визначені дослідним шляхом, тому їх називають «емпіричними».
Таблиця 4: Інформація, яку надає хімічна формула складної речовини
| Відомості | На прикладі C aCO3 |
| Назва речовини | Карбонат кальцію |
| Приналежність елемента до певного класу речовин | Середня (нормальна) сіль |
| Одна молекула речовини | 1 молекула карбонату кальцію |
| Один моль речовини | 6,02 · 10 23молекул CaCO 3 |
| Відносна молекулярна маса речовини (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C)+3Ar(O)=100 |
| Молярна маса речовини (M) | М (CaCO3) = 100 г/моль |
| Абсолютна молекулярна маса речовини (m) | M (CaCO3) = Mr (CaCO3) · 1,66 · 10 -24 г = 1,66 · 10 -22 г |
| Якісний склад (які хімічні елементи утворюють речовину) | кальцій, вуглець, кисень |
| Кількісний склад речовини: | |
| Число атомів кожного елемента в одній молекулі речовини: | молекула карбонату кальцію складається з 1 атомакальцію, 1 атомавуглецю та 3 атомівкисню. |
| Число молей кожного елемента в 1 молі речовини: | В 1 моль СаСО 3(6,02 · 10 23 молекулах) міститься 1 моль(6,02 ·10 23 атомів) кальцію, 1 моль(6,02 ·10 23 атомів) вуглецю та 3 моль(3·6,02·10 23 атомів) хімічного елемента кисню) |
| Масовий склад речовини: | |
| Маса кожного елемента в 1 молі речовини: | 1 моль карбонату кальцію (100г) містить хімічні елементи: 40г кальцію, 12г вуглецю, 48г кисню. |
| Масові частки хімічних елементів у речовині (склад речовини у відсотках за масою):
|
Склад карбонату кальцію за масою:
W (Ca) = (n (Ca) · Ar (Ca)) / Mr (CaCO3) = (1 · 40) / 100 = 0,4 (40%) W (C) = (n (Ca) · Ar (Ca)) / Mr (CaCO3) = (1 · 12) / 100 = 0,12 (12%) W (Про) = (n (Ca) · Ar (Ca)) / Mr (CaCO3) = (3 · 16) / 100 = 0,48 (48%) |
| Для речовини з іонною структурою (солі, кислоти, основи) – формула речовини дає інформацію про кількість іонів кожного виду в молекулі, їх кількість та масу іонів в 1 моль речовини:
|
Молекула СаСО 3складається з іону Са 2+та іона 3 2-
1 моль ( 6,02·10 23молекул) СаСО 3містить 1 моль іонів Са 2+і 1 моль іонів 3 2-; 1 моль (100г) карбонату кальцію містить 40г іонів Са 2+і 60г іонів 3 2- |
| Молярний обсяг речовини за нормальних умов (тільки для газів) | |
Графічні формули
Для отримання більш повної інформації про речовину користуються графічними формулами , які вказують порядок з'єднання атомів у молекуліі валентність кожного елемента.
Графічні формули речовин, що складаються з молекул, іноді, тією чи іншою мірою, відображають і будову (структуру) цих молекул, у цих випадках їх можна назвати структурними .
Для складання графічної (структурної) формули речовини необхідно:
- Визначити валентність усіх хімічних елементів, що утворюють речовину.
- Записати знаки всіх хімічних елементів, що утворюють речовину, кожен у кількості, що дорівнює кількості атомів даного елемента в молекулі.
- Поєднати знаки хімічних елементів рисками. Кожна рисочка означає пару, що здійснює зв'язок між хімічними елементами і тому однаково належить обом елементам.
- Число рис, що оточують знак хімічного елемента, повинно відповідати валентності цього хімічного елемента.
- При складанні формул кисневмісних кислот та їх солей атоми водню та атоми металів зв'язуються з кислотоутворюючим елементом через атом кисню.
- Атоми кисню з'єднують один з одним лише при складанні формул пероксидів.
Приклади графічних формул:
З'ясуймо, як скласти електронну формулу хімічного елемента. Це питання є важливим і актуальним, тому що дає уявлення не тільки про будову, а й про передбачувані фізичні та хімічні властивості аналізованого атома.
Правила складання
Для того щоб скласти графічну та електронну формулу хімічного елемента, необхідно мати уявлення про теорію будови атома. Почнемо з того, що є два основні компоненти атома: ядро та негативні електрони. Ядро включає нейтрони, які не мають заряду, а також протони, що володіють позитивним зарядом.
Розмірковуючи, як скласти та визначити електронну формулу хімічного елемента, відзначимо, що для знаходження числа протонів у ядрі, потрібна періодична система Менделєєва.
Номер елемента по порядку відповідає кількості протонів, що у його ядрі. Номер періоду, в якому розташовується атом, характеризує число енергетичних шарів, які розміщуються на яких електрони.
Для визначення кількості нейтронів, позбавлених електричного заряду, необхідно з величини відносної маси атома елемента, відібрати його порядковий номер (кількість протонів).
Інструкція
Щоб зрозуміти, як скласти електронну формулу хімічного елемента, розглянемо правило заповнення негативними частинками підрівнів, сформульоване Клечковским.
Залежно від того, який запас вільної енергії мають вільні орбіталі, складається ряд, що характеризує послідовність заповнення рівнів електронами.
Кожна орбіталь містить лише два електрони, які розташовуються антипаралельними спинами.
Щоб висловити структуру електронних оболонок, застосовують графічні формули. Яким є електронні формули атомів хімічних елементів? Як складати графічні варіанти? Ці питання включені до шкільного курсу хімії, тому зупинимося на них докладніше.
Існує певна матриця (основа), яку використовують при складанні графічних формул. Для s-орбіталі характерна лише одна квантова осередок, у якій протилежно один одному розташовується два електрони. Їх у графічному вигляді позначаються стрілками. Для р-орбіталі зображують три осередки, у кожній також знаходиться по два електрони, на d орбіталі розташовується десять електронів, а f заповнюється чотирнадцятьма електронами.

Приклади складання електронних формул
Продовжимо розмову у тому, як скласти електронну формулу хімічного елемента. Наприклад, потрібно скласти графічну та електронну формулу для елемента марганцю. Спочатку визначимо становище даного елемента у періодичній системі. Він має 25 порядковий номер, отже, в атомі знаходиться 25 електронів. Марганець - це елемент четвертого періоду, отже, у нього чотири енергетичні рівні.
Як скласти електронну формулу хімічного елемента? Записуємо знак елемента та його порядковий номер. Користуючись правилом Клечковського, розподіляємо за енергетичними рівнями та підрівнями електрони. Послідовно розташовуємо їх на першому, другому, а також третьому рівні, вписуючи в кожну комірку по два електрони.
Далі підсумовуємо їх, отримуючи 20 штук. Три рівні у повному обсязі заповнені електронами, а на четвертому залишається лише п'ять електронів. Враховуючи, що для кожного виду орбіталі характерний свій запас енергії, електрони, що залишилися, розподіляємо на 4s і 3d підрівень. У результаті готова електронно-графічна формула для атома марганцю має такий вигляд:
1s2/2s2, 2p6/3s2, 3p6/4s2, 3d3

Практичне значення
За допомогою електронно-графічних формул можна наочно побачити кількість вільних (неспарених) електронів, що визначають валентність хімічного елемента.
Пропонуємо узагальнений алгоритм дій, за допомогою якого можна скласти електронно-графічні формули будь-яких атомів, що знаходяться в таблиці Менделєєва.
Насамперед необхідно визначити кількість електронів, використовуючи періодичну систему. Цифра періоду свідчить про чисельність енергетичних рівнів.
Приналежність до певної групи пов'язані з кількістю електронів, що є зовнішньому енергетичному рівні. Поділяють рівні на підрівні, заповнюють їх з урахуванням правила Клечковського.

Висновок
Щоб визначити валентні можливості будь-якого хімічного елемента, що у таблиці Менделєєва, необхідно скласти електронно-графічну формулу його атома. Алгоритм, наведений вище, дозволить впоратися з поставленим завданням, визначити можливі хімічні та фізичні властивості атома.
Алгоритм складання електронної формули елемента:
1. Визначте число електронів в атомі за допомогою Періодичної таблиці хімічних елементів Д.І. Менделєєва.
2. За номером періоду, у якому розташований елемент, визначте кількість енергетичних рівнів; кількість електронів на останньому електронному рівні відповідає номеру групи.
3. Рівні розбити на підрівні та орбіталі та заповнити їх електронами відповідно до правил заповнення орбіталей:
Необхідно пам'ятати, що на першому рівні знаходиться максимум 2 електрони 1s 2, на другому - максимум 8 (два sі шість р: 2s 2 2p 6), на третьому - максимум 18 (два s, шість p, і десять d: 3s 2 3p 6 3d 10).
- Головне квантове число nмає бути мінімально.
- Першим заповнюється s-підрівень, потім р-, d-b f-підрівні.
- Електрони заповнюють орбіталі у порядку зростання енергії орбіталей (правило Клечковського).
- У межах підрівня електрони спочатку по одному займають вільні орбіталі, і лише після цього утворюють пари (правило Хунда).
- На одній орбіталі не може бути більше двох електронів (принцип Паулі).
приклади.
1. Складемо електронну формулу азоту. У періодичній таблиці азот знаходиться за №7.

2. Складемо електронну формулу аргону. У періодичній таблиці аргон знаходиться за №18.
1s 2 2s 2 2p 6 3s 2 3p 6.

3. Складемо електронну формулу хрому. У періодичній таблиці хром знаходиться за №24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

Енергетична діаграма цинку.
4. Складемо електронну формулу цинку. У періодичній таблиці цинк знаходиться за №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Звернемо увагу, що частина електронної формули, а саме 1s 2 2s 2 2p 6 3s 2 3p 6 - це електронна формула аргону.
Електронну формулу цинку можна подати у вигляді.
 Ключові особливості нового кодека
Ключові особливості нового кодека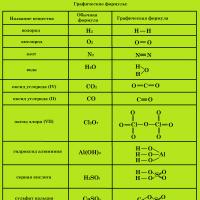 Хімічні формули речовин
Хімічні формули речовин Розділові знаки при прямому мовленні
Розділові знаки при прямому мовленні Покроковий рецепт приготування котлет зі свинячої печінки
Покроковий рецепт приготування котлет зі свинячої печінки Легкий фітнес салат з пекінською капустою та болгарським перцем Салат з пекінської капусти з червоним перцем
Легкий фітнес салат з пекінською капустою та болгарським перцем Салат з пекінської капусти з червоним перцем М'який шоколадний плавлений сир
М'який шоколадний плавлений сир Поема Некрасова "Дідусь": аналіз та характеристика твору
Поема Некрасова "Дідусь": аналіз та характеристика твору